Par le Docteur Philippe Kestemont
pour “MEDITI”
 Notre équipe de recherche clinique (MEDITI) a participé aux études cliniques « AboBoNT-A 189 et 214 » de la forme liquide de l’AboBoNT-A avec le laboratoire IPSEN. Nous participons de fait au « board global» pour le lancement de cette nouvelle formulation, appelée ALLUZIENCE, du laboratoire GALDERMA. Nous proposons une mise au point sur cette neurotoxine « prête à l’emploi »
Notre équipe de recherche clinique (MEDITI) a participé aux études cliniques « AboBoNT-A 189 et 214 » de la forme liquide de l’AboBoNT-A avec le laboratoire IPSEN. Nous participons de fait au « board global» pour le lancement de cette nouvelle formulation, appelée ALLUZIENCE, du laboratoire GALDERMA. Nous proposons une mise au point sur cette neurotoxine « prête à l’emploi »
1. Pourquoi proposer cette formulation ?
Les utilisateurs au quotidien des neurotoxines A lyophilisées ont été confrontés à différentes contraintes et effets indésirables :
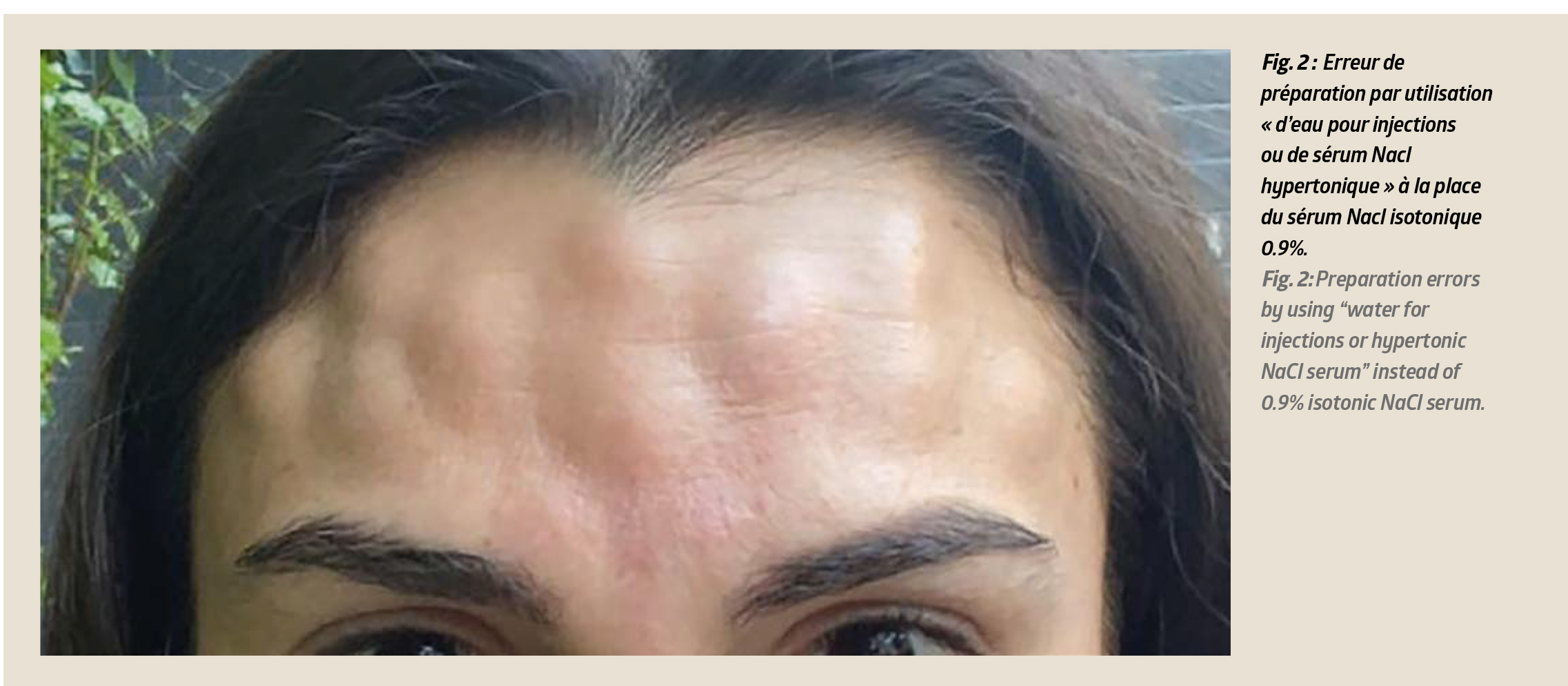
• Erreur de préparation par utilisation « d’eau pour injections ou de sérum Nacl hypertonique » à la place du sérum Nacl isotonique 0.9%. Ces erreurs de manipulation sont sources d’injections hyperalgiques, d’œdèmes faciaux quelquefois spectaculaires, nécessitant l’arrêt immédiat des injections dès les premiers signes et la destruction du flacon. (Fig 2)
• Variabilité des résultats cliniques due aux variations individuelles du volume de sérum salé utilisé pour la dilution, 0.63cc, 0.70 cc, 1cc,1.25cc….
• Problèmes septiques liés à des manipulations multiples du flacon, pour la dilution et le prélèvement.
• Aspect chronophage de la préparation des solutions.
• Coût du matériel pour la préparation, seringues, sérum Nacl 0.9%, aiguilles…
• Mauvaise image auprès des patients de tout produit injectable contenant de l’albumine humaine ou animale.
2. Description de l’AboBoNT-A prête à l’emploi.
- Solution liquide claire, incolore constituée de la même neurotoxine de 150 kDa et des mêmes protéines associées que la poudre AboBoNT-A (Azzalure).
- Développée sans aucun excipent d’origine humaine ou animale (albumine humaine et lactose)
- Ne contient que des excipients végétaux et synthétiques, ce qui maintient l’activité de la toxine dans une préparation liquide.
- Site de fabrication « Green Label » éco-responsable, « BREEAM »
- Le flacon contient au moins 125 U de toxine, dans 0.63 cc de solution. En pratique, il y a une marge supérieure de solution ce qui permet d’évaluer une dose totale majorée de plus de 5%.
- La durée de conservation et les modalités de conservation sont comparables à la forme classique.
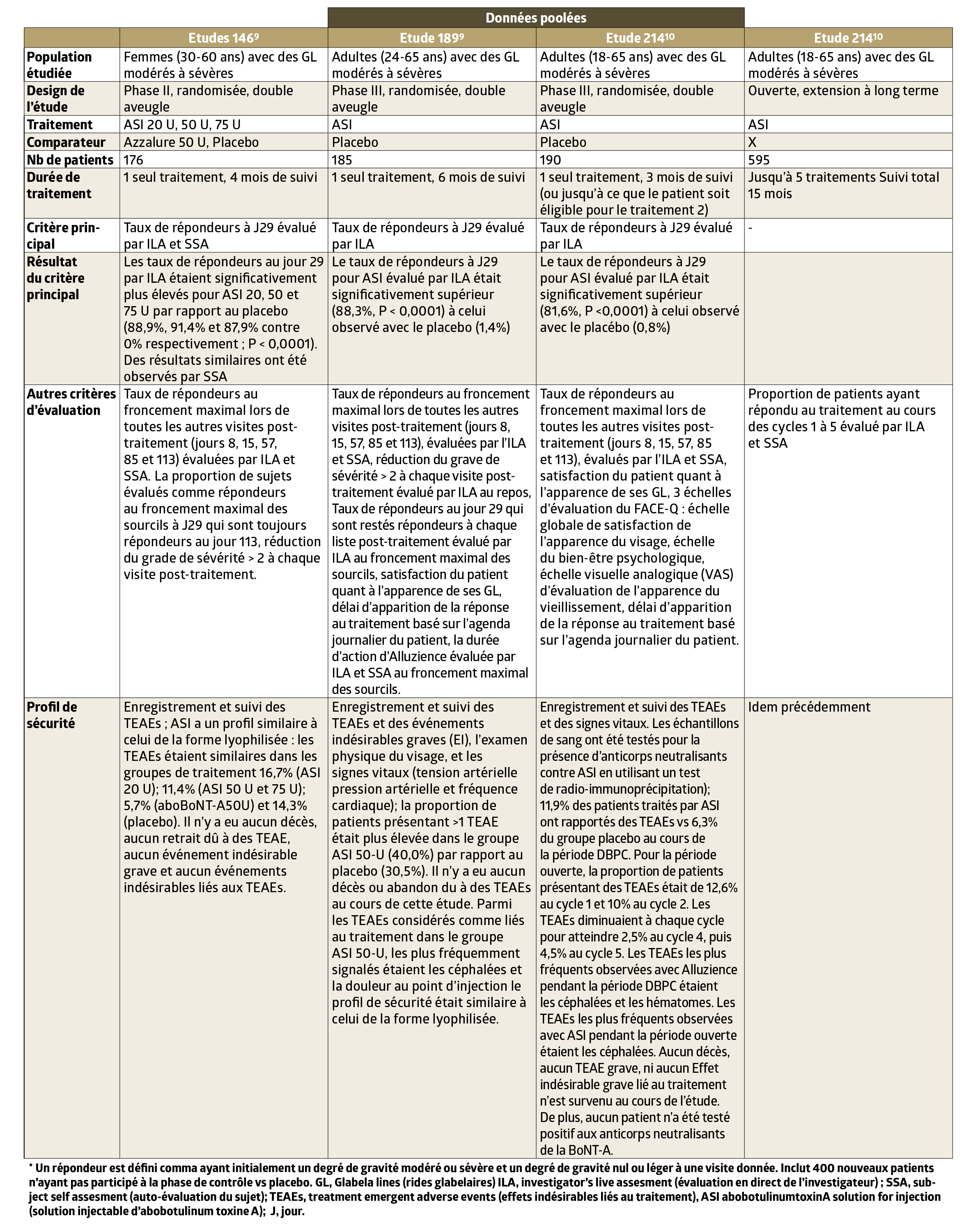
- Les études cliniques ont mis en évidence une rapidité d’action accrue (de 3 jours en moyenne, étude 189) , une durée d’efficacité attestée à 6 mois (études 189 et 214) et une reproductibilité des résultats (étude 214). (Fig 3)
- Satisfaction des patients (Face-Q) élevée dans ces études cliniques
- Sécurité et tolérance comparables par rapport aux formes « poudre ».
3. Au total, quels sont les avantages de la forme liquide ?
- Précision du contenu du flacon, sans aléa de préparation, donc sécurité accrue
- Rapidité d’action clinique
- Durée de l’action clinique
- Reproductibilité des résultats
- Absence d’albumine humaine et animale
- Absence d’anticorps neutralisants retrouvés pendant les cycles de traitement
- Nombre d’unités disponibles dans le flacon supérieur à la forme « poudre »
- Présentation idéale pour l’utilisation de la seringue 3D , avec une réflexion sur l’avenir des seringues préremplies prêtes à l’emploi qui faciliterait l’utilisation en gardant des flacons classiques pour les retouches et mini-doses.
D’autres compagnies travaillent à l’élaboration des formes liquides des neurotoxines ce qui montre l’intérêt porté à l’innovation dans ce domaine.
 Par le Docteur Philippe Kestemont
Par le Docteur Philippe Kestemont
Chirurgien de la face et du cou.
Doctorat de médecine en 1995 à la Faculté de Nice, diplômé « Desc » Face et cou en 1997.
Enseignant associé à la Faculté de médecine de Nice.
Directeur scientifique de Visage, AMWC Monaco. Co-directeur du « Cadaver Course Imcas », Paris. Membre de European Academy of Facial Plastic Surgery. Membre de la Société Française de Chirurgie Plastique et Esthétique de la Face. Membre de la SAMCEP.
Plus d’informations sur docteurkestemont.com